确的操作规程。
本项在《标准》的设备要求一章中有规定,但一般在核对本项时,需核对出厂检验程序、出厂检验报告和计量证明。这也是质控部分
验证的主要方式,所以必须同时验证两个部分的内容。
通过查看记录的检验报告来判断医学设备质控检测是否适合产品检验也是非常有效的,但相关性往往被检验人员忽视。下面用例子来
详细说明检验报告与设备关联的问题。
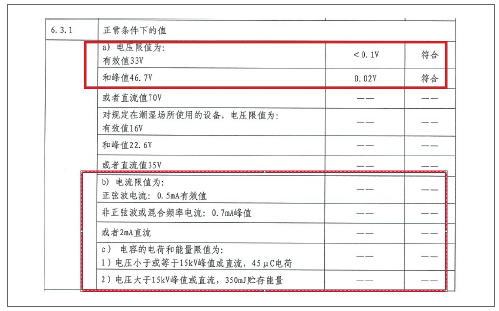
案例:某超声设备制造商在日志系统检查过程中验证了日志检查报告。
日志检验报告反映了患者漏电流测试时直流分量和交流分量的测试结果,而成品检验报告只测试了交流分量,医疗器械检测校准
结果是没有反映在设备的测量证书上,导致检查组对漏电流测试设备的重视。
直流分量测试功能,不能满足出厂检验的需要。记录的检验报告一般对数值要求有限的项目出具具体的检验值。
通过跟踪检测值对应的检测设备,可以检查该设备是否具有出具相应检测值的功能。查看注册检验报告的内容。
检验报告反映了注册时的实际产品检验情况,虽然报告的内容很专业,而且标准术语也很多,但检验员不可能知道所有的技术知识,
但有必要以报告合理检查为检查依据。
通过检查检验报告的内容,结合产品和设备档案的技术要求,更容易发现出厂检验和设备的缺陷。
需要注意的是,检查人员在发现缺陷时,必须客观、彻底地查明原因,收集有关该现象的全链条证据。缺陷的判断必须从局部评价延
伸到对整体风险的评价。并且不应严格基于“规范”条款。
免责声明:带有本公司标识的图片未经授权转载,将追究法律责任;文章部分文字、图片,视频来源于网络,如有侵权,请联系删除,版权归原作者所有。

咨询服务热线
400-699-8388
