医疗器械是医疗业务的重要组成部分,其产品的安全性和有效性与我们的生命健康息息相关,因此世界各国都建立了严格
的管控体系。随着我国相关产业的技术创新和产业链的成熟,医疗器械行业进入高速发展期,市场容量不断扩大,产品认
证需求日益增加。
但是,鉴于当今国际市场上认证种类的多样性和法律的不断变化法规,很多医疗器械生产企业对相关产品的注册/认证内容
和流程知之甚少。以及如何顺利通过注册/认证仍然是很多企业迫切需要解决的问题。
一、什么是医疗器械注册/认证?
医疗器械注册/认证是指食品药品监督管理部门根据医疗器械注册人的请求和法定程序,对医疗器械的安全性和有效性研究
及上市结果进行系统评价,以决定是否批准该医疗器械。申请或不申请的过程。
医疗器械备案是指医疗器械备案人向食品药品监督管理部门备案的备案材料,食品药品监督管理部门将备案的备案材料备
案备查。
二、哪些产品需要进行医疗器械注册/认证?
定义为医疗器械的产品需要注册/认证,通常是指制造商打算用于人体用于以下一种或多种特定医疗目的的仪器、设备、
装置,无论是单独使用还是组合使用,机器、器具、植入物品、体外试剂、软件或其他类似或相关物品。这些目的包括:
诊断、预防、监测、治疗或减轻疾病,诊断、监测、治疗、减轻或补偿伤害,研究、替换、调节或支持解剖或生理过程,
支持或维持生命;怀孕控制;医疗器械的灭菌;通过对人体样本进行体外检查来提供医学信息;其在人体内或人体内所设
计的原发作用不是通过药理学、免疫学或代谢途径获得的,而是可能参与并起辅助作用。
疾病的诊断、预防、监护、治疗或者缓解;损伤的诊断、监护、治疗、缓解或者补偿;
解剖或生理过程的研究、替代、调节或者支持;
支持或维持生命;
妊娠控制;医疗器械的消毒;通过对取自人体的样本进行体外检查的方式来提供医疗信息;
它对人体表面或体内的主要设计效果不是通过药理学、免疫学或代谢手段获得的,但这些手段可能会涉及并起一定的辅助
作用。
值得注意的是,有些产品在某些管辖范围内可认为是医疗器械,而在其他地方不认为是医疗器械的产品包括:
消毒物质;
残疾人的辅助用品;
含有动物和(或)人体组织的器械;
用于体外受精或生育辅助的器械。
三、对于医疗器械注册/认证,当前国际国内的主流法规有哪些?
当前国际国内的主流法规有三大类,分别是中国NMPA医疗器械注册、欧盟CE认证和美国FDA认证:
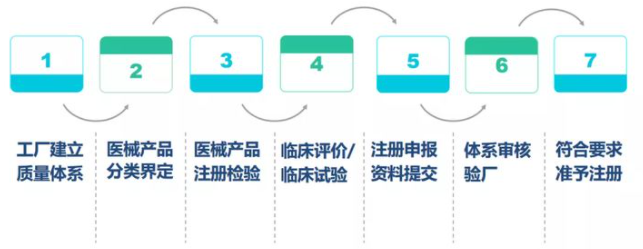
1、 中国NMPA医疗器械注册/备案
根据中国国务院《医疗器械监督管理条例》号规定,任何生产企业在中国境内销售和使用医疗器械(包括国内外器械)都
必须向相应的食品药品监督管理部门进行注册,根据您的风险等级主要分为三类:第一类医疗器械(低风险,如纱布、绷
带等)实行产品档案管理; II类医疗器械(中度风险,如输液器、手术手套等)实行产品档案管理。备案管理,III类医疗
器械器械(支架、人工关节等风险较高的器械)实行产品备案管理。
第一类医疗器械(风险程度低,如纱布、绷带等),实行产品备案管理;
第二类医疗器械(中度风险,如输液器、手术手套等),实行产品注册管理;
第三类医疗器械(较高风险,如支架、人工关节等),实行产品注册管理。
NMPA注册流程如下:
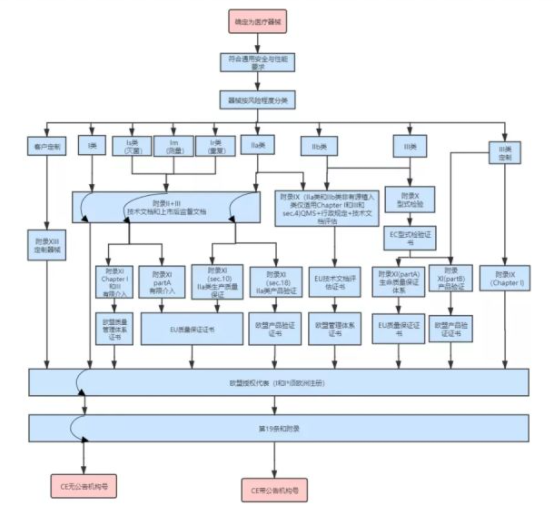
2、 欧盟CE认证
在欧盟市场,“CE”标志是强制性认证标志。无论是欧盟内部公司生产的产品,还是其他国家生产的产品,如果要在欧
盟市场自由流通,都必须加贴“CE标志”,表明产品符合欧盟基础《技术协调与标准化新方法》的要求法规。欧盟CE认
证是进入欧盟市场的通行证。出口到欧盟的医疗器械没有CE认证是不能获批的。根据医疗器械风险的不同,欧盟市场上
的医疗器械分为I、IIa、IIb、III四类:
●低风险性医疗器械属于I类,包括:
○普通I类医疗器械,需出具CE符合性报告;
○具有无菌及测量功能的特殊I类医疗器械,需要CE证书,并在产品包装上打上CE标识。
●中度风险性医疗器械属于IIa类和IIb类,需要CE证书,并在产品包装上打上CE标识。
●高度风险性医疗器械属于III类,需要CE证书,并在产品包装上打上CE标识。
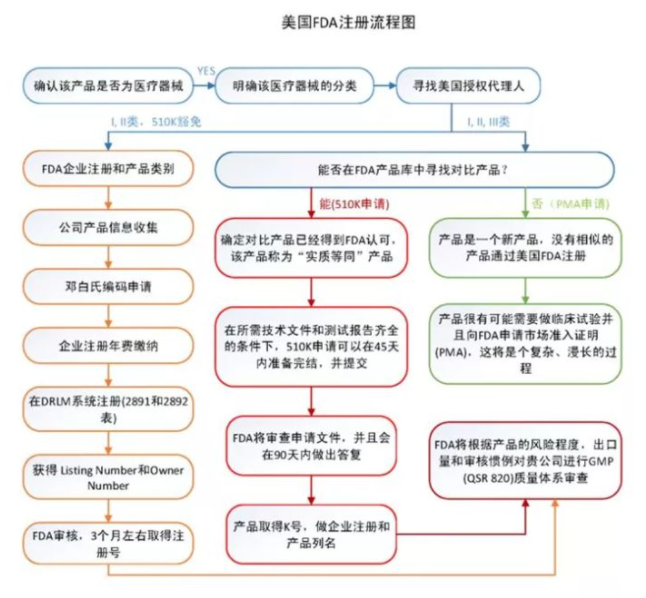
3、 美国FDA认证
FDA认证是美国食品药品监督管理局(FDA)为确保在美国生产或进口的食品、化妆品、药品、生物制剂、设备和放射制
品的安全而建立的审查机制。在数百个国家中,只有FDA - 批准的材料、设备和技术可用于商业临床应用。根据风险等级
的不同,FDA将医疗器械分为三类(I、II、III),其中III类风险等级最高,风险等级越高,监管力度越大。 FDA明确规定
了每种医疗器械的产品分类和管理要求,FDA医疗器械产品目录已收录1700多种产品。 FDA 医疗器械注册的类型包括:
厂家在FDA注册;
产品的FDA登记;
产品上市登记(510表登记);
产品上市审核批准(PMA审核);
医疗保健器械的标签与技术改造、通关、登记、上市前报告。

咨询服务热线
400-699-8388
