动物实验是放射卫生检测评价医疗器械安全性和有效性的重要手段之一。它们属于产品设计开发中的重要研究,可以为产
品设计提供相应的证据支持。如果可以用来为人体研究提供支持,降低临床试验受试者和使用者的风险,为临床试验设计
提供参考。然而,并非所有医疗器械都需要动物试验来验证产品的安全性和有效性。
2019年4月18日,为加强对医疗器械产品注册的监督指导,进一步提高医疗器械注册审评质量,国家药品监督管理局组织制
定了《医疗器械动物实验研究技术审查指导原则第一部分:决策原则》。路径,这是一个重要的里程碑。这是国家食品药品
监督管理总局发布的第一份动物实验文件官方,结束了医疗器械动物实验长期不可控的局面。
2019年11月27日,为进一步规范医疗器械检测校准实验动物研究,医疗器械技术审评中心组织起草了《医疗器械实验动物研
究技术审评系列指南》《医疗器械动物实验研究技术审查指导原则 第二部分:实验设计、实施质量保证(征求意见稿)》
号。设备。申请人可参照该指南开展与动物实验设计、实施和质量保证相关的工作,并将进一步指导申请人在适当负荷下
对医疗器械进行更高质量的动物实验研究。
一、医疗器械临床前动物实验需要明确的问题
1. 医疗器械临床前动物实验的国家行为-指导原则
2007年-2020年7月发布的指导原则文本412条,其中涉及临床前动物实验的文本有2/5,涉及20多类。
2. 医疗器械临床前动物实验的物理性与有效性
动物受体与人体在物理性方面差异极大,物理性是产品有效性的重要组成,因此不完全能通过动物实验来验证受试器械临床
的有效性。
3. 植入性医疗器械临床前动物实验与生物相容性研究
植入性医疗器械定义:通过手术全部或部分插入人体或腔内,或用于指人体上皮表面或眼表,并在人体内保留30年手术后几
天(包含)或更高,或被人体吸收的医疗器械。
二、需要做动物实验的医疗器械类别
1. 决策的原则
申请人可参考《医疗器械动物实验研究技术审查指导原则第一部分:决策原则》中的决策流程图进行是否开展动物实验的决策。
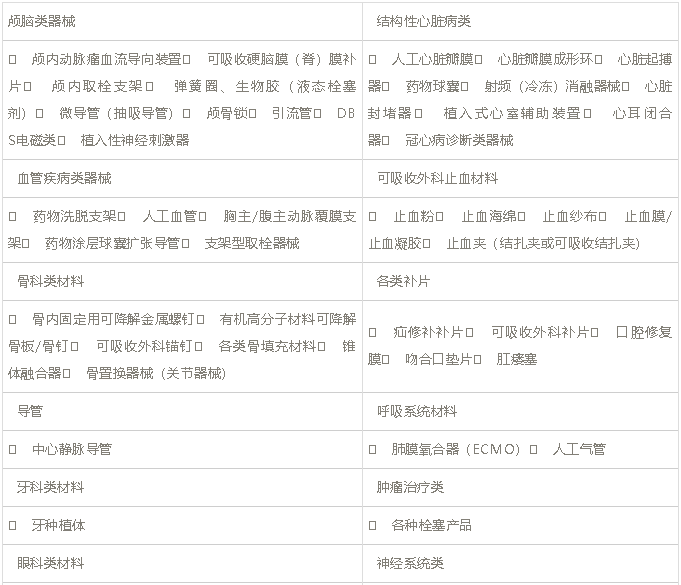
2. 已明确做动物实验的类别
免责声明:带有本公司标识的图片未经授权转载,将追究法律责任;文章部分文字、图片,视频来源于网络,如有侵权,请联系删除,版权归原作者所有。

咨询服务热线
400-699-8388
